-
Módulo 1: Conceptos básicos que debes conocer
En esta primera toma de contacto explicamos qué es exactamente un medicamento, cómo se pueden clasificar y qué características tiene cada grupo. Además, comentamos detalladamente algunos medicamentos especiales como las vacunas, los de origen biológico o los radiofármacos. Este primer módulo es el punto de inicio para el resto de contenidos de Saber de Farma.
- Bienvenido al apasionante mundo de la farmacoterapia
- El medicamento
- Fórmulas magistrales y preparados oficinales
- Medicamentos genéricos y biosimilares
- Medicamentos especiales: vacunas
- Medicamentos especiales: biológicos
- Medicamentos especiales: radiofármacos
- Medicamentos especiales: psicótropos y estupefacientes
- Medicamentos especiales: terapias alternativas
- Medicamentos especiales: huérfanos
- Productos sanitarios
-
Módulo 2: De la investigación al paciente
Continuamos con el módulo 2, en el que realizaremos un viaje de la mano de los medicamentos para ver cómo se desarrollan, pasan a investigación clínica, se comercializan y por fin alcanzan el circuito farmacoterapéutico (prescripción, validación, administración). Además, nos detendremos en temas muy interesantes como la adherencia, los errores de medicación o la publicidad en la farmacia.
- Ética y medicamentos
- Ensayos clínicos
- El precio de los medicamentos
- Medicamentos legales e ilegales
- Medicamentos extranjeros
- Utilización de medicamentos fuera de indicación
- Farmacovililancia
- Fabricación, distribución y dispensación de medicamentos
- El circuito farmacoterapéutico
- ¿Quién puede prescribir medicamentos?
- ¿Dónde se pueden dispensar los medicamentos?
- El farmacéutico
- Farmacia comunitaria
- Farmacia de hospital
- Selección de medicamentos en un hospital
- Administración de medicamentos
- Adherencia al tratamiento
- Derechos y deberes de los pacientes
- Errores de medicación
- Publicidad de los medicamentos
-
Módulo 3: Elaboración y administración de medicamentos
Una vez ya hemos visto todo el circuito de los medicamentos toca empezar a concretar ciertos temas. Veremos cómo se producen los medicamentos o la importancia de los excipientes. Por otro lado, estudiaremos todas las vías de administración que se utilizan con sus particularidades y las formas farmacéuticas que se emplean.
- Color, olor y sabor de los medicamentos
- Isoapariencia y errores de confusión
- Excipientes de declaración obligatoria
- Lactosa e intolerancia a la lactosa
- Vía oral y sublingual
- Formas farmacéuticas sólidas vía oral y sublingual
- Formas farmacéuticas líquidas vía oral
- Vía parenteral
- Formas farmacéuticas parenterales
- Vía inhalatoria
- Formas farmacéuticas vía inhalatoria
- Vía tópica (cutánea, ocular, ótica)
- Formas farmacéuticas tópicas
- Otras vías y sus formas farmacéuticas
- ¿Por qué esa vía, dosis y ese intervalo?
- Tomar medicamentos: ¿por la mañana o por la noche?
-
Módulo 4: El medicamento en nuestro organismo
Llegó la hora de entrar con el fármaco en nuestro organismo y ver qué pasa exactamente. Estudiaremos la absorción, distribución, metabolismo y excreción de los fármacos y sus implicaciones prácticas. También estudiaremos temas tan interesantes como la interacción entre medicamentos, con alimentos o con el alcohol. Para terminar veremos algunas de las reacciones adversas más frecuentes de los medicamentos con sus recomendaciones generales.
- Recorrido del medicamento en el organismo: Proceso LADME
- Liberación y absorción de los medicamentos
- Metabolismo y excreción de los medicamentos
- Reacciones adversas
- Reacciones de fotosensibilidad
- Interacciones entre medicamentos
- Interacciones medicamentos y alimentos
- Interacciones medicamentos y plantas medicinales
- La importancia de estar bien hidratados
- Conducción y medicamentos
- Tabaco y medicamentos
- Alcohol y medicamentos
- Alteraciones del sueño y medicamentos
- Manejo de las reacciones gastrointestinales
- Reacciones dermatológicas a medicamentos
- Análisis clínicos y medicamentos
- Alergias a medicamentos
- Intoxicación con medicamentos
-
Módulo 5: Medicamentos y poblaciones especiales
Después de haber visto qué pasaba con el fármaco en el organismo toca estudiar como algunas condiciones pueden influir en estos procesos. Temas muy interesantes y prácticos para entender muchas recomendaciones que se realizan en las consultas.
-
Módulo 6: Buscando información sobre medicamentos
Aunque Saber de Farma es un temario bastante amplio no queremos que te quedes aquí. En este módulo te decimos donde puedes encontrar información útil y veraz sobre los medicamentos y la farmacia.
-
Módulo 7: Los medicamentos en el hogar
Acabamos el temario de Saber de Farma con los temas más prácticos. Hablaremos sobre cómo y dónde guardar los medicamentos en casa, por qué los medicamentos tienen fecha de caducidad y cómo se calcula o de los medicamentos recomendados para llevar de viaje.
Ensayos clínicos
Hugo Ribes Artero
Todos hemos oído hablar de los ensayos clínicos alguna vez en la televisión, radio o en los periódicos, pero… ¿Conocemos realmente qué son los ensayos clínicos? En este post intentaremos dar a conocer un poco más esta rama de la investigación científica.
Un ensayo clínico se define como la evaluación experimental de un medicamento en seres humanos con el fin de conocer alguno de los siguientes apartados:
- Cómo se comporta el medicamento en el cuerpo (por ejemplo, cuánto tiempo tarda en eliminarse del organismo)
- Para qué problema de salud se puede utilizar.
- Cuáles son sus reacciones adversas.
Un poco de historia…
Se considera como el primer ensayo clínico de la historia el que realizó el cirujano británico James Lind en el siglo XVIII a bordo del buque Salisbury sobre una enfermedad llamada escorbuto y provocada por la falta de vitamina C en la dieta. Descubrió que la solución era incluir cítricos en la dieta después de tratar a varios grupos de marineros con diferentes alimentos, como vinagre, sidra agua de mar o naranjas.
Unos años después, el médico inglés Edward Jenner desarrolló la primera vacuna contra la viruela. Para probar que funcionaba decidió administrársela a un niño sano y luego inocularle a través de unos cortes en el brazo pus procedente de una mujer infectada con viruela. Al ver que no se contagiaba comprobó que funcionaba.
La historia de los ensayos clínicos está llena de científicos que han sobrepasado los límites morales y éticos con el fin de conocer mejor y curar las enfermedades. Sin duda, las mayores locuras llegaron con los experimentos Nazis en Auschwitz a cargo del Coronel Josef Mengele.
Después de la Segunda Guerra Mundial, la sociedad tuvo que reflexionar sobre la investigación médica. A consecuencia de los Juicios de Nuremberg contra los dirigentes y colaboradores nazis se publicó el Código de Nuremberg que recogía los principios éticos que deben regir toda investigación en humanos. Más tarde, en 1964 se promulgó la Declaración de Helsinki por la Asociación Médica Mundial con el fin de autorregularse.

Pero por desgracia ahí no acabó todo. Menos conocido es el llamado “Caso Tuskegee” que ocurrió en Estados Unidos entre 1932 y 1972. Durante estos años, en el estado de Alabama se investigó la evolución de la sífilis en hombres de raza negra. Los participantes en el estudio nunca dieron su consentimiento informado y no se les informó debidamente de lo que se les iba a hacer. Participaron bajo la promesa de los investigadores de que recibirían tratamiento médico gratuito para su enfermedad pero nunca recibieron el antibiótico que les hubiese curado fácilmente.
A raíz de estos sucesos, el Congreso de los EEUU formó la Comisión Nacional para la Protección de los Sujetos Humanos ante la Investigación Biomédica y de Comportamiento que en 1979 publicó el Informe Belmont. En este informe aparecen por primera vez los principios básicos de la bioética: respeto por las personas, beneficencia y justicia. Con el tiempo estos principios pasaron a ser 4: Autonomía, no-maleficencia, beneficencia y justicia.
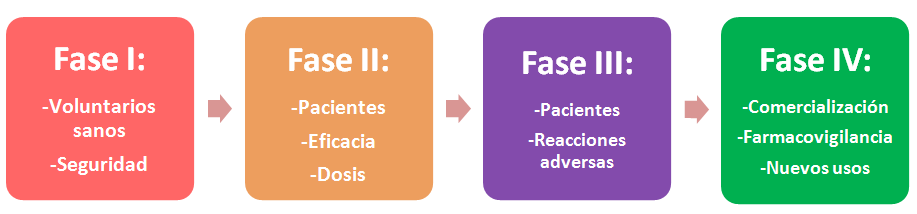
Fases de un ensayo clínico
Un ensayo clínico se puede clasificar en 4 fases, siendo la finalidad de cada una de ellas distinta:
-
Fase I: Es el primer paso en la investigación de un medicamento nuevo. Su objetivo principal es evaluar la tolerancia/seguridad del fármaco en humanos. Los voluntarios que participan en esta fase son personas sanas. ¿Hay excepciones? La respuesta es sí. Si el medicamento a evaluar es un fármaco para el cáncer, como es lógico, los participantes serán personas que padecen algún tipo de enfermedad oncológica.
-
Fase II: En este caso los participantes son un número limitado de pacientes que padecen la enfermedad contra la que va actuar el nuevo medicamento. En esta fase se comienzan a recopilar datos sobre la eficacia, se completan los datos de seguridad de la fase I y se establecen las dosis que se usarán para este medicamento.
-
Fase III: Esta fase es parecida a la II pero con un número mayor de pacientes. Se compara el medicamento nuevo con los medicamentos ya comercializados que se usan para la misma enfermedad (o con placebo) y es en este punto donde se tienen que establecer cuáles son los efectos adversos que tendrá el nuevo medicamento. La información obtenida en esta fase será crucial para que la AEMPS autorice la comercialización del medicamento.
-
Fase IV: El medicamento ya está aprobado y comercializado pero con el paso del tiempo pueden aparecer reacciones adversas que llamamos a largo plazo. Estas reacciones se detectan por los profesionales sanitarios y, en caso de aparecer, las comunican a la AEMPS. A esta fase se le llama también de farmacovigilancia. Además, en esta fase el laboratorio farmacéutico que tiene la patente del medicamento puede investigar si la sustancia del medicamento es eficaz contra otras enfermedades.
¿Cómo son los medicamentos de los ensayos?
Los medicamentos en ensayo clínico tienen que tener un etiquetado especial, que indique el código del ensayo al cual pertenecen, además de otros datos más comunes como el lote y la caducidad.
En algunos casos, pueden contener un número de kit. Este número es único para cada frasco, bote, jeringa… Esto es debido a que para conseguir un seguimiento más individualizado en el ensayo se suele asociar cada número de kit a un participante del ensayo en concreto. Esta asociación se hace de forma aleatoria por medios informáticos.

Dependiendo del ensayo, el medicamento puede tener o no el nombre del fármaco en la etiqueta. Esto dependerá de si el ensayo es ciego o no… ¿Y qué significa ciego?
Hablamos de ensayo CIEGO cuando el voluntario desconoce qué medicamento está recibiendo. Y si aparte de los voluntarios los profesionales que intervienen en el ensayo tampoco lo conocen hablamos de DOBLE CIEGO. La única forma de conocer esta información es a través del sistema informático que asigna a cada voluntario un número de medicamento. Este sistema tiene su justificación, y es que los resultados que se obtienen en estos casos podemos decir que están libres de que algún investigador participante hayan podido manipular de algún modo qué voluntario recibe uno u otro medicamento y libre también del efecto que podría tener sobre la salud del paciente el hecho de conocer qué está tomando.
Legalmente, los medicamentos en investigación sólo pueden usarse en las personas voluntarias que están participando en ellos, pero existe una excepción y es el llamado uso compasivo.
Esto consiste en que una persona enferma que no participa en ningún ensayo puede recibir un medicamento que aun se está investigando. Para ellos, deben de cumplirse dos aspectos:
- Paciente padece una enfermedad gravemente debilitante o que su vida corra peligro.
- No existe ningún tratamiento comercializado que pueda tratar al paciente.
El consentimiento informado
El consentimiento informado es, probablemente, el aspecto más importante de todo ensayo clínico. Se trata del documento en el cual consta que una persona entra voluntariamente en un ensayo clínico. Este consentimiento tiene que cumplir con 4 requisitos:
- Capacidad: la persona debe de ser capaz de dar el consentimiento por si sola
- Voluntariedad: nadie puede obligar a un persona a entrar en el ensayo
- Información: se ha informado completamente a la persona
- Comprensión: la persona ha entendido la información que se le ha dado
Si la persona que va a participar en el ensayo es discapacitada, la ley recoge que la información se le ofrecerá en formatos adecuados para favorecer que pueda prestar por sí su consentimiento. En el caso de que sus capacidades se encuentren modificadas y no pueda dar el consentimiento por sí mismo, será su representante legalmente elegido el que prestará el consentimiento.
En el caso de menores, serán sus padres o representante legal del menor los que firmarán el consentimiento. Además, si el menos es mayor de 12 años y sus condiciones lo permiten, también deberá constar su consentimiento en el documento.
Por último, en cualquier momento, sin necesidad de justificación y sin consecuencias legales cualquier persona que haya entrado de forma voluntaria en un ensayo podrá abandonarlo.
Información adicional
Algunos enlaces para continuar aprendiendo sobre los ensayos:
Agencia Española de Medicamentos y Productos Sanitarios
Modelo de la AEMPS de Consentimiento Informado para ensayos
Libro de ensayos clínicos en España. SEFH
¿Qué hemos aprendido?
- Un ensayo clínico se define como la evaluación experimental de un medicamento en seres humanos.
- Se distinguen cuatro fases:
- Fase I: se evalúa la tolerancia y seguridad del fármaco. Se realiza normalmente en voluntarios sanos.
- Fase II: se comienza a recopilar datos sobre la eficacia y se completan los datos de seguridad.
- Fase III: parecida a la II pero con un número mayor de pacientes.
- Fase IV: se realiza con el fármaco ya comercializado para detectar reacciones adversas de aparición tardía.