-
Módulo 1: Conceptos básicos que debes conocer
En esta primera toma de contacto explicamos qué es exactamente un medicamento, cómo se pueden clasificar y qué características tiene cada grupo. Además, comentamos detalladamente algunos medicamentos especiales como las vacunas, los de origen biológico o los radiofármacos. Este primer módulo es el punto de inicio para el resto de contenidos de Saber de Farma.
- Bienvenido al apasionante mundo de la farmacoterapia
- El medicamento
- Fórmulas magistrales y preparados oficinales
- Medicamentos genéricos y biosimilares
- Medicamentos especiales: vacunas
- Medicamentos especiales: biológicos
- Medicamentos especiales: radiofármacos
- Medicamentos especiales: psicótropos y estupefacientes
- Medicamentos especiales: terapias alternativas
- Medicamentos especiales: huérfanos
- Productos sanitarios
-
Módulo 2: De la investigación al paciente
Continuamos con el módulo 2, en el que realizaremos un viaje de la mano de los medicamentos para ver cómo se desarrollan, pasan a investigación clínica, se comercializan y por fin alcanzan el circuito farmacoterapéutico (prescripción, validación, administración). Además, nos detendremos en temas muy interesantes como la adherencia, los errores de medicación o la publicidad en la farmacia.
- Ética y medicamentos
- Ensayos clínicos
- El precio de los medicamentos
- Medicamentos legales e ilegales
- Medicamentos extranjeros
- Utilización de medicamentos fuera de indicación
- Farmacovililancia
- Fabricación, distribución y dispensación de medicamentos
- El circuito farmacoterapéutico
- ¿Quién puede prescribir medicamentos?
- ¿Dónde se pueden dispensar los medicamentos?
- El farmacéutico
- Farmacia comunitaria
- Farmacia de hospital
- Selección de medicamentos en un hospital
- Administración de medicamentos
- Adherencia al tratamiento
- Derechos y deberes de los pacientes
- Errores de medicación
- Publicidad de los medicamentos
-
Módulo 3: Elaboración y administración de medicamentos
Una vez ya hemos visto todo el circuito de los medicamentos toca empezar a concretar ciertos temas. Veremos cómo se producen los medicamentos o la importancia de los excipientes. Por otro lado, estudiaremos todas las vías de administración que se utilizan con sus particularidades y las formas farmacéuticas que se emplean.
- Color, olor y sabor de los medicamentos
- Isoapariencia y errores de confusión
- Excipientes de declaración obligatoria
- Lactosa e intolerancia a la lactosa
- Vía oral y sublingual
- Formas farmacéuticas sólidas vía oral y sublingual
- Formas farmacéuticas líquidas vía oral
- Vía parenteral
- Formas farmacéuticas parenterales
- Vía inhalatoria
- Formas farmacéuticas vía inhalatoria
- Vía tópica (cutánea, ocular, ótica)
- Formas farmacéuticas tópicas
- Otras vías y sus formas farmacéuticas
- ¿Por qué esa vía, dosis y ese intervalo?
- Tomar medicamentos: ¿por la mañana o por la noche?
-
Módulo 4: El medicamento en nuestro organismo
Llegó la hora de entrar con el fármaco en nuestro organismo y ver qué pasa exactamente. Estudiaremos la absorción, distribución, metabolismo y excreción de los fármacos y sus implicaciones prácticas. También estudiaremos temas tan interesantes como la interacción entre medicamentos, con alimentos o con el alcohol. Para terminar veremos algunas de las reacciones adversas más frecuentes de los medicamentos con sus recomendaciones generales.
- Recorrido del medicamento en el organismo: Proceso LADME
- Liberación y absorción de los medicamentos
- Metabolismo y excreción de los medicamentos
- Reacciones adversas
- Reacciones de fotosensibilidad
- Interacciones entre medicamentos
- Interacciones medicamentos y alimentos
- Interacciones medicamentos y plantas medicinales
- La importancia de estar bien hidratados
- Conducción y medicamentos
- Tabaco y medicamentos
- Alcohol y medicamentos
- Alteraciones del sueño y medicamentos
- Manejo de las reacciones gastrointestinales
- Reacciones dermatológicas a medicamentos
- Análisis clínicos y medicamentos
- Alergias a medicamentos
- Intoxicación con medicamentos
-
Módulo 5: Medicamentos y poblaciones especiales
Después de haber visto qué pasaba con el fármaco en el organismo toca estudiar como algunas condiciones pueden influir en estos procesos. Temas muy interesantes y prácticos para entender muchas recomendaciones que se realizan en las consultas.
-
Módulo 6: Buscando información sobre medicamentos
Aunque Saber de Farma es un temario bastante amplio no queremos que te quedes aquí. En este módulo te decimos donde puedes encontrar información útil y veraz sobre los medicamentos y la farmacia.
-
Módulo 7: Los medicamentos en el hogar
Acabamos el temario de Saber de Farma con los temas más prácticos. Hablaremos sobre cómo y dónde guardar los medicamentos en casa, por qué los medicamentos tienen fecha de caducidad y cómo se calcula o de los medicamentos recomendados para llevar de viaje.
Farmacovililancia
María Martín Cerezuela
¿Qué son las reacciones adversas?
Una reacción adversa es un efecto nocivo o no deseado que produce un medicamento tras su administración a dosis utilizadas normalmente en las personas, bien para la profilaxis, el diagnóstico o el tratamiento de una enfermedad. Por ejemplo, una reacción adversa típica de ibuprofeno es el dolor de estómago.

¿Qué es la farmacovigilancia?
Es la actividad de la Salud Pública que se encarga de la identificación, cuantificación, evaluación y prevención de las reacciones adversas de los medicamentos. El objetivo de la farmacovigilancia es que todos los medicamentos se utilicen de la forma más segura, para que su beneficio sea superior a los riesgos que puedan producir.
¿Qué es el Sistema Español de Farmacovigilancia?
La Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) es el organismo responsable de controlar los medicamentos y de tomar las medidas necesarias para proteger a los ciudadanos en el caso de que hubiera algún problema. En esta tarea colaboran las Comunidades Autónomas, a través de los 17 Centros Autonómicos de Farmacovigilancia que existen en España.
Cada uno se encarga de recoger y evaluar las notificaciones de sospechas de reacciones que se producen en su Comunidad Autónoma (tanto las que proceden de los profesionales sanitarios como de los propios ciudadanos) y las incorpora a una base de datos informatizada a nivel nacional llamada FEDRA (Farmacovigilancia Española de Reacciones Adversas).
Desde FEDRA se transmite la información de todos los casos de sospechas de reacciones adversas a medicamentos notificados en España a la base de datos europea Eudravigilance (European Union Drug Regulating Authorities Pharmacovigilance) para que pueda estar a disposición de todas las agencias reguladoras de medicamentos a nivel europeo.

Aquí podéis consultar el directorio de Centros Autonómicos de Farmacovigilancia en España.
¿Cómo puedo notificar una sospecha de reacción adversa?
Cuando sospeche una reacción adversa a un medicamento, se recomienda que consulte con su médico o farmacéutico. Los profesionales sanitarios pueden notificar la sospecha directamente a través del formulario “tarjeta amarilla” o a través de los laboratorios farmacéuticos titulares de los medicamentos.
Tanto los profesionales sanitarios como los propios ciudadanos también pueden comunicar sospechas de reacciones adversas a través de un formulario electrónico en Internet, disponible aquí. El propio sistema informático envía los casos directamente a cada Centro Autonómico de Farmacovigilancia quien se encarga de gestionarlos.
¿Qué es la Tarjeta Amarilla?
Es el formulario en papel de recogida de sospechas de reacciones adversas, editada en color amarillo, y distribuida por los Centros Autonómicos de Farmacovigilanicia a los profesionales sanitarios de su Comunidad Autónoma para permitir la notificación. Recoge información relativa al paciente (edad, sexo, peso…), al fármaco (nombre, dosis, vía de administración…), a la reacción adversa (descripción, fecha de aparición…) y al profesional que notifica la sospecha. Una vez completada se envía por correo postal al Centro Autonómico de Farmacovigilancia correspondiente.

¿Qué ocurre luego con esa información?
Los Centros Autonómicos de Farmacovigilancia y la Agencia Española de Medicamentos y Productos Sanitarios evalúan toda la información que se les notifica, junto con la información que se recoge de estudios clínicos. Cuando existe suficiente información para determinar que un grupo de casos similares de sospechas de reacciones adversas están probablemente causados por un medicamento, esta información se traslada a la ficha técnica (información dirigida al profesional sanitario) y al prospecto que se incluye en el envase (dirigido al paciente). Otras veces se limita la prescripción a ciertos médicos especialistas, se recomienda su uso bajo restricciones o condiciones específicas o se establece como tratamiento de segunda elección.
La Agencia Española de Medicamentos y Productos Sanitarios emite Notas informativas que están disponibles en su página web y que se distribuyen a través de las Comunidades Autónomas, organizaciones colegiales y sociedades científicas.
En este enlace puede consultar todas las notas informativas emitidas por la AEMPS.
¿Por qué es importante notificar las reacciones adversas?
Todos los medicamentos son susceptibles de producir reacciones adversas. Algunas aparecen inmediatamente tras la toma del fármaco, pero hay otros efectos que aparecen a lo largo del tiempo. Es importante que las personas informen a su médico, farmacéutico u otro personal sanitario para poder detectar y prevenir de manera precoz estas reacciones adversas. Es especialmente útil notificar reacciones que no aparecen en el prospecto del medicamento, si se trata de un medicamento nuevo, si ocurre cuando está tomando más de un medicamento a la vez o si ha ocurrido como resultado de un error involuntario en la prescripción, dispensación o administración de la medicación.
¿Cómo se atribuye una reacción adversa a un fármaco específico?
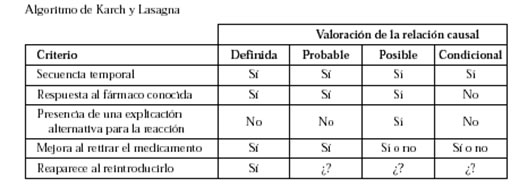
En ocasiones es muy complicado determinar que una reacción adversa la ha ocasionado un fármaco concreto. Este problema puede haberse producido por sí solo, de manera secundaria a la enfermedad por la cual toma el medicamento, o incluso debido a otros medicamentos. Todo ello complica mucho el establecimiento de la relación causa-efecto. Una manera de establecer esta relación que ha sido muy utilizada es con el algoritmo de Karch y Lasagna de 1977. Según 5 criterios se establece la relación causal de una reacción adversa con un medicamento que puede ser desde definida hasta condicional.
Algunos medicamentos retirados en España por Farmacovigilancia
Rofecoxib: es un antiinflamatorio no esteroideo (AINE) que se utilizaba para el alivio del dolor en artrosis. Fue retirado del mercado en 2004 por motivos de seguridad, ya que se demostró que su uso a largo plazo y a dosis altas suponía un alto riesgo de alteraciones a nivel cardíaco.
Carisoprodol: se utilizaba sólo o en combinación con paracetamol para dolores de espalda, contracturas musculares y otros tipos de traumatismos. En 2008, las autoridades sanitarias suspendieron su comercialización puesto que los riesgos de abuso y dependencia asociados al carisodropol eran superiores a los beneficios que aportaba.
Sibutramina: este medicamento se utilizaba para la pérdida de peso en personas con obesidad o sobrepeso junto a dieta y aumento de la actividad física. En un estudio realizado en 2002, se observó que tras el tratamiento a largo plazo con sibutramina la pérdida de peso conseguida era inferior a la esperada. Además, este estudio demostró que los pacientes que recibían este tratamiento tenían mayor riesgo de sufrir infarto de miocardio o un ataque cerebral en comparación con las personas que tomaban placebo. Por todo ello, en 2010, se decidió su cese de comercialización.
Rosiglitazona: se trata de un medicamento para la diabetes. En 2010 se decidió retirarlo ya que tras su evaluación, los riesgos de tipo cardiovascular que suponía el uso de este medicamento eran superiores a sus beneficios.
¿Qué hemos aprendido?
- Una reacción adversa es un efecto nocivo o no deseado que se produce por la toma de un medicamento.
- El Sistema Español de Farmacovigilancia se encarga de recopilar y gestionar las reacciones adversas.
- La tarjeta amarilla es el formulario para la notificación de reacciones adversas por parte de los profesionales sanitarios.
- El algoritmo de Karch y Lasagna ayuda a establecer la relación entre un medicamento y una reacción adversa.
