-
Módulo 1: Conceptos básicos que debes conocer
En esta primera toma de contacto explicamos qué es exactamente un medicamento, cómo se pueden clasificar y qué características tiene cada grupo. Además, comentamos detalladamente algunos medicamentos especiales como las vacunas, los de origen biológico o los radiofármacos. Este primer módulo es el punto de inicio para el resto de contenidos de Saber de Farma.
- Bienvenido al apasionante mundo de la farmacoterapia
- El medicamento
- Fórmulas magistrales y preparados oficinales
- Medicamentos genéricos y biosimilares
- Medicamentos especiales: vacunas
- Medicamentos especiales: biológicos
- Medicamentos especiales: radiofármacos
- Medicamentos especiales: psicótropos y estupefacientes
- Medicamentos especiales: terapias alternativas
- Medicamentos especiales: huérfanos
- Productos sanitarios
-
Módulo 2: De la investigación al paciente
Continuamos con el módulo 2, en el que realizaremos un viaje de la mano de los medicamentos para ver cómo se desarrollan, pasan a investigación clínica, se comercializan y por fin alcanzan el circuito farmacoterapéutico (prescripción, validación, administración). Además, nos detendremos en temas muy interesantes como la adherencia, los errores de medicación o la publicidad en la farmacia.
- Ética y medicamentos
- Ensayos clínicos
- El precio de los medicamentos
- Medicamentos legales e ilegales
- Medicamentos extranjeros
- Utilización de medicamentos fuera de indicación
- Farmacovililancia
- Fabricación, distribución y dispensación de medicamentos
- El circuito farmacoterapéutico
- ¿Quién puede prescribir medicamentos?
- ¿Dónde se pueden dispensar los medicamentos?
- El farmacéutico
- Farmacia comunitaria
- Farmacia de hospital
- Selección de medicamentos en un hospital
- Administración de medicamentos
- Adherencia al tratamiento
- Derechos y deberes de los pacientes
- Errores de medicación
- Publicidad de los medicamentos
-
Módulo 3: Elaboración y administración de medicamentos
Una vez ya hemos visto todo el circuito de los medicamentos toca empezar a concretar ciertos temas. Veremos cómo se producen los medicamentos o la importancia de los excipientes. Por otro lado, estudiaremos todas las vías de administración que se utilizan con sus particularidades y las formas farmacéuticas que se emplean.
- Color, olor y sabor de los medicamentos
- Isoapariencia y errores de confusión
- Excipientes de declaración obligatoria
- Lactosa e intolerancia a la lactosa
- Vía oral y sublingual
- Formas farmacéuticas sólidas vía oral y sublingual
- Formas farmacéuticas líquidas vía oral
- Vía parenteral
- Formas farmacéuticas parenterales
- Vía inhalatoria
- Formas farmacéuticas vía inhalatoria
- Vía tópica (cutánea, ocular, ótica)
- Formas farmacéuticas tópicas
- Otras vías y sus formas farmacéuticas
- ¿Por qué esa vía, dosis y ese intervalo?
- Tomar medicamentos: ¿por la mañana o por la noche?
-
Módulo 4: El medicamento en nuestro organismo
Llegó la hora de entrar con el fármaco en nuestro organismo y ver qué pasa exactamente. Estudiaremos la absorción, distribución, metabolismo y excreción de los fármacos y sus implicaciones prácticas. También estudiaremos temas tan interesantes como la interacción entre medicamentos, con alimentos o con el alcohol. Para terminar veremos algunas de las reacciones adversas más frecuentes de los medicamentos con sus recomendaciones generales.
- Recorrido del medicamento en el organismo: Proceso LADME
- Liberación y absorción de los medicamentos
- Metabolismo y excreción de los medicamentos
- Reacciones adversas
- Reacciones de fotosensibilidad
- Interacciones entre medicamentos
- Interacciones medicamentos y alimentos
- Interacciones medicamentos y plantas medicinales
- La importancia de estar bien hidratados
- Conducción y medicamentos
- Tabaco y medicamentos
- Alcohol y medicamentos
- Alteraciones del sueño y medicamentos
- Manejo de las reacciones gastrointestinales
- Reacciones dermatológicas a medicamentos
- Análisis clínicos y medicamentos
- Alergias a medicamentos
- Intoxicación con medicamentos
-
Módulo 5: Medicamentos y poblaciones especiales
Después de haber visto qué pasaba con el fármaco en el organismo toca estudiar como algunas condiciones pueden influir en estos procesos. Temas muy interesantes y prácticos para entender muchas recomendaciones que se realizan en las consultas.
-
Módulo 6: Buscando información sobre medicamentos
Aunque Saber de Farma es un temario bastante amplio no queremos que te quedes aquí. En este módulo te decimos donde puedes encontrar información útil y veraz sobre los medicamentos y la farmacia.
-
Módulo 7: Los medicamentos en el hogar
Acabamos el temario de Saber de Farma con los temas más prácticos. Hablaremos sobre cómo y dónde guardar los medicamentos en casa, por qué los medicamentos tienen fecha de caducidad y cómo se calcula o de los medicamentos recomendados para llevar de viaje.
¿Qué es la AEMPS?
Ana García Robles
La Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), se creó en 1999 y depende del Ministerio de Sanidad, Servicios Sociales e Igualdad. Su responsabilidad es garantizar a la sociedad la calidad, seguridad, eficacia y correcta información de los medicamentos y productos sanitarios, desde el inicio de su investigación hasta que se consume.

Para poder llevar a cabo su función, desarrolla muchas actividades, entre las que se encuentran:
- La autorización de investigaciones con medicamentos y productos sanitarios.
- La autorización e inspección de los laboratorios farmacéuticos y de los fabricantes de principios activos.
- La evaluación y autorización de medicamentos de uso humano y veterinario tras comprobar que cumplen las condiciones de calidad, seguridad y eficacia.
- La supervisión del suministro y el abastecimiento de los medicamentos.
- El seguimiento continuo de la seguridad y eficacia de los medicamentos una vez comercializados.
- La lucha contra los medicamentos, productos sanitarios y cosméticos ilegales y falsificados.
¿Quién forma la AEMPS?
El equipo humano de la AEMPS está formado por cerca de 500 profesionales cualificados, entre los que destacan licenciados y doctores en farmacia, medicina, veterinaria, biología, química, derecho e ingenieros informáticos entre otros. Además, cuenta con comités científicos y comités de coordinación especializados en las principales áreas de intervención y el apoyo de una Red de Expertos externos.
¿Cómo se evalúan y autorizan los medicamentos?
Los medicamentos regulados por la AEMPS incluyen productos tan variados como los medicamentos de origen químico o biotecnológico, derivados de la sangre, vacunas, medicamentos a base de plantas, radiofármacos o terapias celulares.
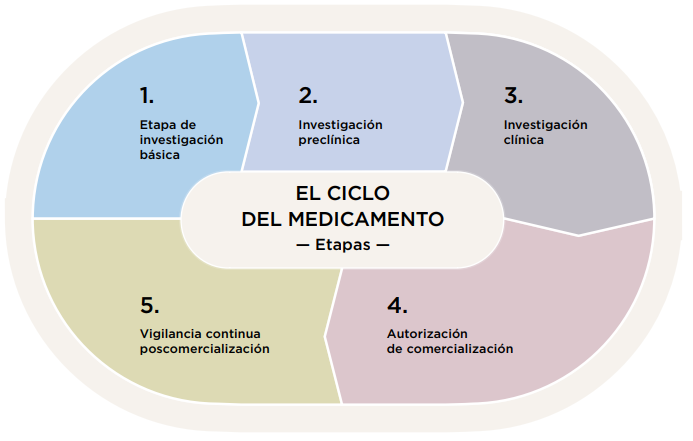
Los medicamentos están regulados a lo largo de todo su ciclo de vida, que incluye 5 etapas:
- Investigación básica (búsqueda de nuevas moléculas, estructuras químicas, síntesis…).
- Investigación preclínica (las moléculas que han pasado la fase anterior con éxito, se estudian en animales de experimentación y en modelos de laboratorio para evaluar su seguridad y actividad).
- Investigación clínica (demostrar que el medicamento estudiado consigue realmente eficacia en el tratamiento de la enfermedad para la que se dirige con un perfil aceptable de reacciones adversas).
- Autorización de comercialización.
- Vigilancia continua postcomercialización.
Ningún medicamento puede comercializarse en España sin la autorización previa de la AEMPS o de la Comisión Europea. Esta autorización se concede según criterios técnicos sobre la calidad, seguridad y la eficacia del medicamento y permite evaluar la relación entre sus beneficios y riesgos.
Desde hace años, existen criterios técnicos comunes en la Unión Europea para la evaluación y autorización de los medicamentos, y esto permite que se puedan autorizar mediante una autorización nacional (un solo país) o una autorización válida para más países europeos.
Cuando la evaluación de un medicamento es positiva, se emite una autorización para su comercialización que incluye las condiciones establecidas por la AEMPS para su uso adecuado (como por ejemplo: dosis, precauciones, contraindicaciones,…). Estas condiciones se recogen en la información sobre el uso del medicamento destinada a los profesionales sanitarios (disponible en la ficha técnica) y a los pacientes (en el prospecto de cada medicamento).
Para conocer si un medicamento está o no autorizado se puede consultar el Centro de Información online de Medicamentos de la AEMPS (CIMA), o su aplicación móvil, que ofrece una información permanentemente actualizada.
¿Cómo se vigilan los medicamentos?
Una vez que el medicamento ha sido comercializado, la AEMPS continúa garantizando la calidad, seguridad, eficacia y correcta información de los medicamentos a través de los sistemas de farmacovigilancia, las inspecciones, los controles de calidad y la lucha contra los medicamentos ilegales y falsificados, informando a los ciudadanos y profesionales sanitarios.
Los sistemas de farmacovigilancia se ocupan de detectar, coordinar, estudiar y prevenir las reacciones adversas y cualquier problema relacionado con los medicamentos, incluidos los errores de medicación que provocan daños en el paciente. Todos los medicamentos pueden producir reacciones adversas, y el objetivo de la AEMPS es intentar conocerlas lo antes posible, para poder realizar una evaluación correcta de la relación beneficio-riesgo.
El Sistema Español de Farmacovigilancia humana recibe cada año entre 13.000 y 15.000 notificaciones de sospechas de reacciones adversas. Desde hace ya varios años, además de los profesionales sanitarios y la industria farmacéutica, los ciudadanos pueden notificar las sospechas de reacciones adversas a través de la página web www.notificaram.es.
La farmacovigilancia permite llevar a cabo acciones informativas, actualizaciones en las fichas técnicas y los prospectos, o incluso, de forma excepcional, retirar medicamentos del mercado.
¿Cómo informa la AEMPS a los ciudadanos?
La AEMPS desarrolla numerosas acciones informativas, entre las que destacan las llevadas a cabo a través de su web www.aemps.gob.es y la realización de campañas informativas.
Cada año, la AEMPS publica en la web más de 200 notas informativas y alertas, a las que se suman notas de prensa, diferentes publicaciones como guías, recomendaciones, informes, documentos de consenso, de preguntas y respuestas o protocolos.
Entre la información que proporciona se encuentra: qué medicamentos están autorizados, sus condiciones de utilización, disponibilidad, problemas de suministro, suspensiones, retiradas, problemas de seguridad, medicamentos ilegales, alertas por problemas de calidad, etc., siempre desde el punto de vista de protección de la salud de los ciudadanos.
En este enlace podéis ver un vídeo informativo de la AEMPS:
¿Qué hemos aprendido?
- La AEMPS es una agencia estatal que depende del Ministerio de Sanidad, Servicios Sociales e Igualdad.
- Los medicamentos están regulados a lo largo de todo su ciclo de vida: desde las investigaciones iniciales hasta su utilización, con el objetivo de garantizar a la sociedad la calidad, seguridad, eficacia e información correcta.
- Los ciudadanos pueden notificar las sospechas de reacciones adversas a través de la página web wwww.notificaram.es.
