-
Módulo 1: Conceptos básicos que debes conocer
En esta primera toma de contacto explicamos qué es exactamente un medicamento, cómo se pueden clasificar y qué características tiene cada grupo. Además, comentamos detalladamente algunos medicamentos especiales como las vacunas, los de origen biológico o los radiofármacos. Este primer módulo es el punto de inicio para el resto de contenidos de Saber de Farma.
- Bienvenido al apasionante mundo de la farmacoterapia
- El medicamento
- Fórmulas magistrales y preparados oficinales
- Medicamentos genéricos y biosimilares
- Medicamentos especiales: vacunas
- Medicamentos especiales: biológicos
- Medicamentos especiales: radiofármacos
- Medicamentos especiales: psicótropos y estupefacientes
- Medicamentos especiales: terapias alternativas
- Medicamentos especiales: huérfanos
- Productos sanitarios
-
Módulo 2: De la investigación al paciente
Continuamos con el módulo 2, en el que realizaremos un viaje de la mano de los medicamentos para ver cómo se desarrollan, pasan a investigación clínica, se comercializan y por fin alcanzan el circuito farmacoterapéutico (prescripción, validación, administración). Además, nos detendremos en temas muy interesantes como la adherencia, los errores de medicación o la publicidad en la farmacia.
- Ética y medicamentos
- Ensayos clínicos
- El precio de los medicamentos
- Medicamentos legales e ilegales
- Medicamentos extranjeros
- Utilización de medicamentos fuera de indicación
- Farmacovililancia
- Fabricación, distribución y dispensación de medicamentos
- El circuito farmacoterapéutico
- ¿Quién puede prescribir medicamentos?
- ¿Dónde se pueden dispensar los medicamentos?
- El farmacéutico
- Farmacia comunitaria
- Farmacia de hospital
- Selección de medicamentos en un hospital
- Administración de medicamentos
- Adherencia al tratamiento
- Derechos y deberes de los pacientes
- Errores de medicación
- Publicidad de los medicamentos
-
Módulo 3: Elaboración y administración de medicamentos
Una vez ya hemos visto todo el circuito de los medicamentos toca empezar a concretar ciertos temas. Veremos cómo se producen los medicamentos o la importancia de los excipientes. Por otro lado, estudiaremos todas las vías de administración que se utilizan con sus particularidades y las formas farmacéuticas que se emplean.
- Color, olor y sabor de los medicamentos
- Isoapariencia y errores de confusión
- Excipientes de declaración obligatoria
- Lactosa e intolerancia a la lactosa
- Vía oral y sublingual
- Formas farmacéuticas sólidas vía oral y sublingual
- Formas farmacéuticas líquidas vía oral
- Vía parenteral
- Formas farmacéuticas parenterales
- Vía inhalatoria
- Formas farmacéuticas vía inhalatoria
- Vía tópica (cutánea, ocular, ótica)
- Formas farmacéuticas tópicas
- Otras vías y sus formas farmacéuticas
- ¿Por qué esa vía, dosis y ese intervalo?
- Tomar medicamentos: ¿por la mañana o por la noche?
-
Módulo 4: El medicamento en nuestro organismo
Llegó la hora de entrar con el fármaco en nuestro organismo y ver qué pasa exactamente. Estudiaremos la absorción, distribución, metabolismo y excreción de los fármacos y sus implicaciones prácticas. También estudiaremos temas tan interesantes como la interacción entre medicamentos, con alimentos o con el alcohol. Para terminar veremos algunas de las reacciones adversas más frecuentes de los medicamentos con sus recomendaciones generales.
- Recorrido del medicamento en el organismo: Proceso LADME
- Liberación y absorción de los medicamentos
- Metabolismo y excreción de los medicamentos
- Reacciones adversas
- Reacciones de fotosensibilidad
- Interacciones entre medicamentos
- Interacciones medicamentos y alimentos
- Interacciones medicamentos y plantas medicinales
- La importancia de estar bien hidratados
- Conducción y medicamentos
- Tabaco y medicamentos
- Alcohol y medicamentos
- Alteraciones del sueño y medicamentos
- Manejo de las reacciones gastrointestinales
- Reacciones dermatológicas a medicamentos
- Análisis clínicos y medicamentos
- Alergias a medicamentos
- Intoxicación con medicamentos
-
Módulo 5: Medicamentos y poblaciones especiales
Después de haber visto qué pasaba con el fármaco en el organismo toca estudiar como algunas condiciones pueden influir en estos procesos. Temas muy interesantes y prácticos para entender muchas recomendaciones que se realizan en las consultas.
-
Módulo 6: Buscando información sobre medicamentos
Aunque Saber de Farma es un temario bastante amplio no queremos que te quedes aquí. En este módulo te decimos donde puedes encontrar información útil y veraz sobre los medicamentos y la farmacia.
-
Módulo 7: Los medicamentos en el hogar
Acabamos el temario de Saber de Farma con los temas más prácticos. Hablaremos sobre cómo y dónde guardar los medicamentos en casa, por qué los medicamentos tienen fecha de caducidad y cómo se calcula o de los medicamentos recomendados para llevar de viaje.
Medicamentos genéricos y biosimilares
María José Company Albir
Medicamentos genéricos
Los medicamentos genéricos son fármacos desarrollados a partir de otro fármaco de referencia al que se le ha expirado la patente (ha perdido la protección). Para poder comercializarse como un fármaco genérico debe cumplir cuatro condiciones respecto al de referencia:
- Mismo principio activo
- Misma dosis
- Misma forma farmacéutica
- Ser bioequivalente al fármaco de referencia
La bioequivalencia consiste en que dos medicamentos tengan una biodisponibilidad muy parecida. La biodisponibilidad se define como el porcentaje de dosis que consigue llegar a nuestro organismo. Como ya estudiaremos en el módulo 4, no toda la dosis que contiene un medicamento se absorbe, un porcentaje se pierde en el tránsito por el tubo digestivo. Así, para que un medicamento genérico se considere igual que el de referencia tiene que demostrar que este porcentaje, su biodisponiblidad, es equivalente.
Para poder demostrarlo se realizan ensayos clínicos de bioequivalencia en voluntarios sanos (personas que no están enfermas). Consisten en demostrar que dos fármacos con un mismo principio activo presentan una biodisponibilidad tan semejante que se puede asumir que su efecto final será el mismo. Por tanto, la bioequivalencia garantiza que un medicamento genérico sea intercambiable con el de referencia. Para que dos fármacos se consideren bioequivalentes, la diferencia en la biodisponibilidad debe ser inferior a 20%.
Los medicamentos genéricos, son moléculas pequeñas sintetizadas químicamente u obtenidas mediante fermentación microbiana simple, lo que permite que se puedan hacer productos exactos al original (medicamento que obtuvo la patente). La gran ventaja de estos fármacos es que los costes de desarrollo son mucho menores que el original porque no se tiene que desarrollar una nueva molécula ni realizar ensayos clínicos. Es por ello que el precio de salida al mercado de los genéricos es de media un 40% menor.
La única diferencia entre los genéricos y los fármacos de referencia se puede encontrar en los excipientes utilizados. Como estudiamos en el tema 2, los excipientes son sustancias sin actividad farmacológica utilizados para facilitar el proceso de fabricación y de absorción.
Los fármacos genéricos se pueden identificar fácilmente porque presentan en el embalaje externo las siglas EFG que significan Equivalente Farmacéutico Genérico. Además su nombre siempre está formado por el principio activo más el nombre del laboratorio que lo comercializa.
Mitos de los genéricos
Con la comercialización de los primeros genéricos, allá por el año 1997 en España, surgió el debate sobre si eran igual de efectivos que los de marca. El principal mito sobre los genéricos trata sobre que pueden tener un 20% más o menos de principio activo con respecto al medicamento de marca. Este hecho es falso. Lo que sí puede variar en un 20% es la biodisponibilidad, la cual se considera que no tienen ninguna relevancia en el efecto final del fármaco.
Sin embargo, para algunos principios activos en los que una pequeña variación puede provocar un gran cambio en el efecto y/o toxicidad, el margen que se permite es mucho más reducido. Incluso, en algunos grupos de fármacos no se permite el intercambio entre medicamentos (ej. el anticoagulante Sintrom no se sustituye por genéricos en España).
Otro mito es que los genéricos tienen excipientes peores y que eso afecta a la absorción del fármaco y a su eficacia. Los excipientes pueden ser los mismos o diferentes pero en cualquier caso tienen que cumplir las mismas normativas europeas. De hecho, en muchos casos una misma industria fabrica tanto el medicamento de marca como el genérico de forma exactamente igual pero son comercializados por diferentes laboratorios farmacéuticos.
Medicamentos biosimilares
Son fármacos desarrollados a partir de otro fármaco biológico de referencia al que se le ha expirado la patente. Deben cumplir las siguientes condiciones:
- Misma composición
- Misma dosis
- Misma vía de administración
- Misma eficacia y seguridad
Estos fármacos son producidos por síntesis biológica, es decir, se obtienen a partir de un organismo vivo, por lo que pueden existir diferencias en el producto. Por tanto, a diferencia de los medicamentos genéricos, no son copias exactas.
Los fabricantes de productos biológicos deben cumplir con un amplio conjunto de regulaciones y normativas para asegurar la calidad, seguridad y eficacia de los productos biológicos. Al tratarse de moléculas biológicas complejas se desconocen los efectos que podrían tener pequeñas modificaciones en el producto o en el proceso de fabricación, por eso, los estudios necesarios para la autorización de un biosimilar son más exigentes que los solicitados para un genérico. Por lo tanto, se deben realizar ensayos preclínicos (en animales o “in vitro”) y clínicos (en humanos) para asegurar la similitud.
En general, los costes de desarrollo de estos fármacos son elevados ya que se trata de un proceso más complejo como veremos en el tema 6. La diferencia en costes respecto al medicamento de referencia se debe principalmente al marketing y la promoción del producto por parte de la industria farmacéutica. El precio final de mercado puede ser un 15-30% menor que el fármaco original.
La progresiva pérdida de la patente por parte de los biológicos y la consecuente irrupción de los biosimilares ha generado un debate acerca de su posible intercambiabilidad. Su llegada al mercado con un menor precio puede abrir la puerta a políticas de sustitución que, para algunos expertos, no se puede producir de forma automática como sucede con los genéricos.
Algunos autores coinciden en que la controversia de la intercambiabilidad proviene de la posible existencia de reacciones adversas (sobre todo de tipo alérgico). No obstante, esta situación también se produce cuando se intercambian dos medicamentos biotecnológicos de referencia, lo que forma parte de la práctica clínica habitual.
La legislación española hace referencia a que los fármacos biosimilares no pueden ser sustituidos durante la dispensación como ocurre con los genéricos. En este caso, debe ser el prescriptor el que prescriba la marca del biológico que considere adecuado.
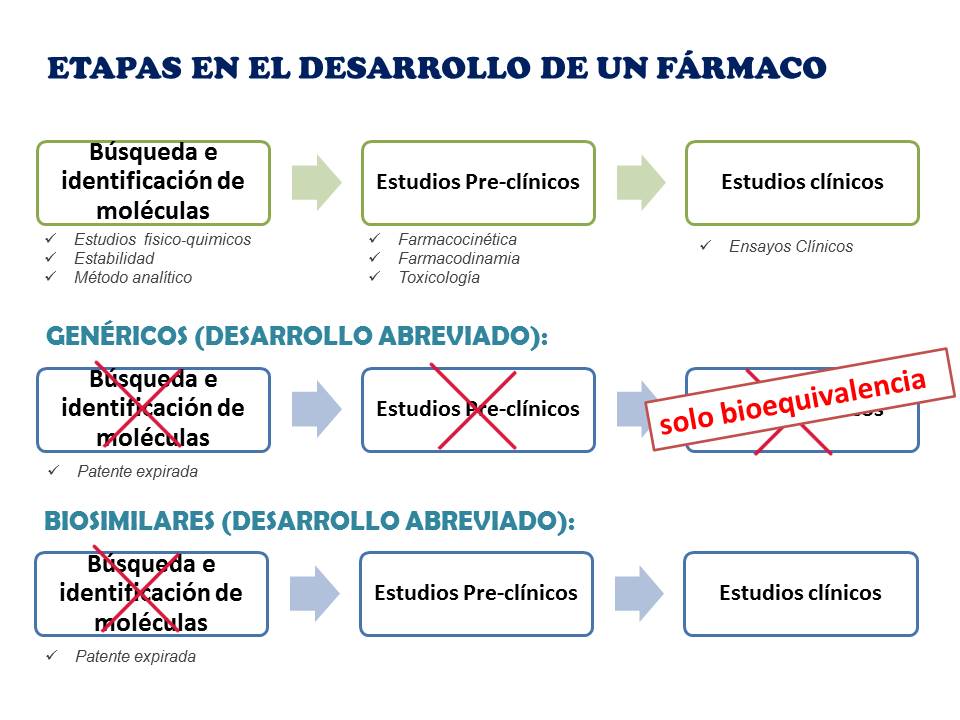
Diferencias entre genéricos y biosimilares
Aunque los biosimilares y los genéricos tienen ciertas analogías, existen grandes diferencias entre ellos:
- Los medicamentos genéricos son idénticos a los originales de marca, mientras que los biosimilares son moléculas similares, no idénticas
- La legislación española no permite la sustitución de un medicamento de marca por un biosimilar en la dispensación, mientras que es algo que se establece como práctica habitual con los medicamentos genéricos.
- La Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) es el organismo que evalúa todos los datos necesarios antes de autorizar la comercialización de medicamentos genéricos, mientras que la Agencia Europea del Medicamento (EMA) es el organismo encargado de autorizar a nivel centralizado en toda Europa la comercialización de biosimilares
- Los medicamentos biosimilares tienen un coste y un tiempo de desarrollo muy superior al de los medicamentos genéricos, ya que el proceso es mucho más complejo al tratarse de moléculas grandes.
Las principales diferencias entre genéricos y biosimilares se resumen en la siguiente tabla:
| GENÉRICOS | BIOSIMILARES |
|---|---|
| Bioequivalentes (igual composición cuantitativa y cualitativa) | Biosimilitud (no son idénticos) |
| Síntesis química/ fermentación microbiana simple | Síntesis biológica |
| Regulado por AEMPS | Regulados por EMA |
| Se pueden sustituir | No se pueden intercambiar ni sustituir |
| Estudios de bioequivalencia | Necesarios Ensayos Clínicos |
| Tiempo de desarrollo 3-4 años | Tiempo de desarrollo 7-9 años |
| Bajo coste de producción | Alto coste de producción |
¿Qué hemos aprendido?
- Un medicamento genérico y uno biosimilar no son lo mismo.
- Los genéricos deben demostrar la bioequivalencia con el fármaco de referencia.
- Los biosimilares deben demostrar ser comparables en eficacia y seguridad con el fármaco biológico de referencia.
- La autorización de los genéricos y biosimilares por las autoridades competentes garantizan su eficacia y seguridad.
